I+D10 de junio, 2024
Los datos de seguimiento de lorlatinib muestran una supervivencia libre de progresión prolongada en el cáncer de pulmón avanzado ALK positivo
 Pfizer
Pfizer
Un 60% de los pacientes permanecen vivos sin progresión de la enfermedad cinco años después
NOTICIAS RELACIONADAS
Pfizer ha anunciado hoy los resultados de seguimiento a largo plazo del estudio CROWN7,8, ensayo en Fase III que evalúa lorlatinib (▼Lorviqua®), un inhibidor ALK positivo de tercera generación, en comparación con crizotinib, en pacientes con cáncer de pulmón no microcítico (CPNM) avanzado ALK positivo no tratados previamente7. Tras cinco años de seguimiento, la mediana de supervivencia libre de progresión basada en la evaluación del investigador no se ha alcanzado aún con lorlatinib. Según los datos, hay un 81% de reducción en la tasa de progresión de la enfermedad o fallecimiento en comparación con crizotinib. Además, el 60% de los pacientes tratados con lorlatinib estaban vivos sin progresión de la enfermedad después de cinco años, en comparación con el 8% en el grupo de tratamiento con crizotinib. Estos datos serán presentados hoy en una ponencia oral en la reunión anual de 2024 de la Sociedad Americana de Oncología Clínica (ASCO) (Abstract LBA8503), además han sido a su vez publicados en la revista científica Journal of Clinical Oncology8.
“Estos resultados del ensayo CROWN no tienen precedentes, ya que el 60% de los pacientes tratados con lorlatinib siguen vivos tras cinco años sin progresión de la enfermedad”, ha explicado el Dr. Roger Sansey, director de Desarrollo de Oncología en Pfizer. “Estos resultados son un excelente ejemplo del compromiso de Pfizer para descubrir y desarrollar innovaciones científicas para los pacientes, y apoyan a lorlatinib como estándar en el tratamiento de primera línea para pacientes con cáncer de pulmón no microcítico avanzado ALK positivo.”
Cáncer de pulmón, primera causa oncológica de defunción en el mundo
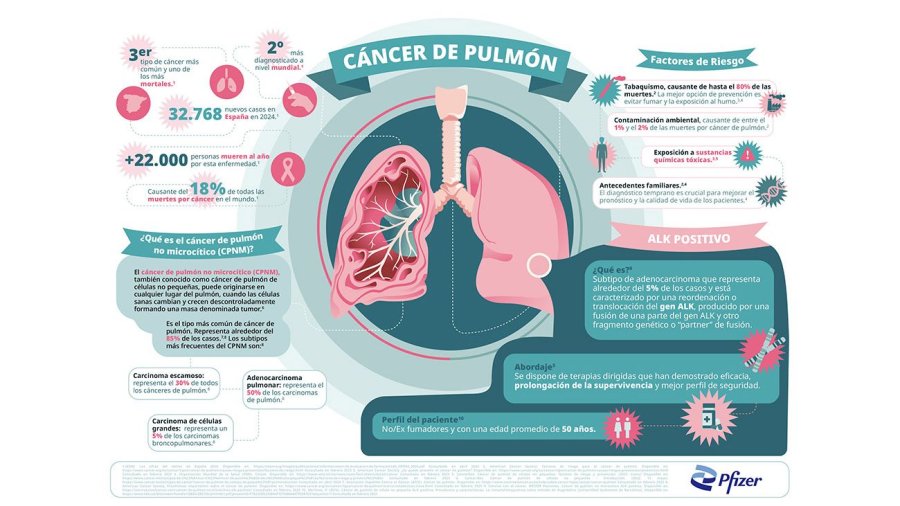
El cáncer de pulmón es la primera causa de muerte por cáncer en el mundo2 y solo en este 2024 se estima que en España habrá 32.768 nuevos casos diagnosticados1. El CPNM representa el 85% de los casos de cáncer de pulmón3,4, siendo el subtipo ALK positivo alrededor del 3-5% de los casos de CPNM5. Aproximadamente un 25-40% de personas con CPNM avanzado ALK positivo presentarán metástasis cerebrales en el momento del diagnóstico inicial, y el 50-60% de los pacientes pueden desarrollar metástasis cerebral durante los dos primeros años de su tratamiento6. Lorlatinib ha sido específicamente diseñado y desarrollado por Pfizer para inhibir las mutaciones tumorales que impulsan la resistencia a otros inhibidores ALK9,11,13,14,15 y penetrar la barrera hematoencefálica9,10,12.
“El cáncer de pulmón no microcítico ALK positivo avanzado suele ser agresivo y afectar a personas jóvenes en la flor de la vida,” ha comentado el Dr. Benjamin Solomon, especialista del departamento de Oncología Médica del Centro Oncológico Peter MacCallum y principal investigador del ensayo CROWN. “Este análisis actualizado muestra que lorlatinib ayudó a los pacientes a vivir más tiempo sin progresión de la enfermedad, y la mayoría de los pacientes experimentaron un beneficio sostenido durante más de cinco años, incluidos casi todos los pacientes que tenían protección contra la progresión de la enfermedad en el cerebro. Estas mejoras en el desenlace de pacientes con CPNM ALK positivo representan un avance notable en cáncer de pulmón.”
Resultados esperanzadores para los pacientes de cáncer de pulmón
En este análisis actualizado, lorlatinib mostró una reducción del 94% en el riesgo de desarrollar progresión intracraneal (CI, por sus siglas en inglés). La mediana del tiempo hasta la progresión de la CI no se alcanzó con lorlatinib y fue de 16,4 meses con crizotinib. En las personas sin metástasis cerebrales al inicio del tratamiento que recibieron lorlatinib, solo 4 de 114 desarrollaron metástasis cerebrales dentro de los primeros 16 meses de tratamiento, en comparación con 39 de 109 pacientes que recibieron crizotinib. En el momento del análisis, el 50% de los pacientes del ensayo CROWN seguían recibiendo lorlatinib en comparación con el 5% de los pacientes que recibían crizotinib.
“A pesar de que el cáncer de pulmón no microcítico avanzado ALK positivo solo supone aproximadamente el 5% de todos los casos de cáncer de pulmón no microcítico, se traduce en 72.000 personas que son diagnosticadas en el mundo cada año”, ha comentado el Dr. Kenneth Culver, director de Investigación y Asuntos clínicos en la organización sin ánimo de lucro ALK Positive. “Estos nuevos resultados del ensayo CROWN simbolizan un avance significativo en el tratamiento específico de primera línea del cáncer de pulmón ALK positivo, que ha dado lugar a notables mejoras para la comunidad de pacientes.”
Los perfiles de seguridad de lorlatinib y crizotinib en el seguimiento a 5 años han sido consistentes con los resultados anteriores7,8.
Referencias
1. SEOM. Las cifras del cáncer en España 2024. Disponible en: https://seom.org/images/publicaciones/informes-seom-de-evaluacion-de-farmacos/LAS_CIFRAS_2024.pdf Consultado en abril 2024
2. World Health Organization. International Agency for Research on Cancer. GLOBOCAN 2022: DOI: 10.3322/caac.21834. Global Population Fact sheet: https://gco.iarc.who.int/media/globocan/factsheets/populations/900-world-fact-sheet.pdf
3. Asociación Española Contra el Cáncer (AECC). Cáncer de pulmón. Disponible en: https://www.contraelcancer.es/es/todo-sobre-cancer/tipos-cancer/cancer-pulmon Consultado en febrero 2023
4. American Cancer Society. Estadísticas importantes sobre el cáncer de pulmón. Disponible en: https://www.cancer.org/es/cancer/tipos/cancer-de-pulmon/acerca/estadisticas-clave.html Consultado en febrero 2023
5. Garber K. ALK, lung cancer, and personalized therapy: portent of the future? J Natl Cancer Inst. 2010;102:672-675.
6. Rangachari D, Yamaguchi N, VanderLaan PA, et al. Brain metastases in patients with EGFR-mutated or ALK—rearranged non—small—cell lung cancers. Lung Cancer. 2015;88(1):108—111 DOI: 10.1016/j.lungcan.2015.01.020.
7. Shaw AT, Bauer TM, de Marinis F, et al. First-Line Lorlatinib or Crizotinib in Advanced ALK-Positive Lung Cancer. N Engl J Med. 2020;383(21):2018-2029. doi:10.1056/NEJMoa2027187
8. Publicacion JCO
9. Johnson TW, Richardson PF, Bailey S, et al. Discovery of (10R)-7-amino-12-fluoro-2,10,16-trimethyl-15-oxo-10,15,16,17-tetrahydro-2H-8,4-(metheno)pyrazolo[4,3-h][2,5,11]-benzoxadiazacyclotetradecine-3-carbonitrile (PF-06463922), a macrocyclic inhibitor of anaplastic lymphoma kinase (ALK) and c-ros oncogene 1 (ROS1) with preclinical brain exposure and broad-spectrum potency against ALK-resistant mutations. J Med Chem. 2014;57(11):4720-4744. doi:10.1021/jm500261q
10. Collier TL, Normandin MD, Stephenson NA, et al. Synthesis and preliminary PET imaging of 11C and 18F isotopologues of the ROS1/ALK inhibitor lorlatinib. Nat Commun. 2017;8:15761. Published 2017 Jun 8. doi:10.1038/ncomms15761
11. Zou HY, Friboulet L, Kodack DP, et al. PF-06463922, an ALK/ROS1 Inhibitor, Overcomes Resistance to First and Second Generation ALK Inhibitors in Preclinical Models. Cancer Cell. 2015;28(1):70-81. doi:10.1016/j.ccell.2015.05.010
12. Felip E, Shaw AT, Bearz A, et al. Intracranial and extracranial efficacy of lorlatinib in patients with ALK-positive non-small-cell lung cancer previously treated with second-generation ALK TKIs. Ann Oncol. 2021;32(5):620-630. doi:10.1016/j.annonc.2021.02.012
13. Gainor JF, Dardaei L, Yoda S, et al. Molecular Mechanisms of Resistance to First- and Second-Generation ALK Inhibitors in ALK-Rearranged Lung Cancer. Cancer Discov. 2016;6(10):1118-1133. doi:10.1158/2159-8290.CD-16-0596
14. Shaw AT, Solomon BJ, Besse B, et al. ALK Resistance Mutations and Efficacy of Lorlatinib in Advanced Anaplastic Lymphoma Kinase-Positive Non-Small-Cell Lung Cancer. J Clin Oncol. 2019;37(16):1370-1379. doi:10.1200/JCO.18.02236
15. Yoda S, Lin JJ, Lawrence MS, et al. Sequential ALK Inhibitors Can Select for Lorlatinib-Resistant Compound ALK Mutations in ALK-Positive Lung Cancer. Cancer Discov. 2018;8(6):714-729. doi:10.1158/2159-8290.CD-17-1256
▼Este medicamento está sujeto a seguimiento adicional, es prioritaria la notificación de sospechas de reacciones adversas asociadas a este medicamento.







